-
关于必赢网址bwi437

-
-
新闻动态

-
技术服务

-
研发项目

-
-
mRNA LNPs平台新方向:体内CAR-T(M)疗法
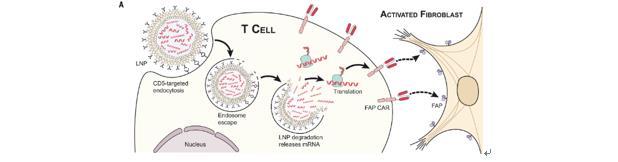
2022年1月6日,美国宾夕法尼亚大学佩雷尔曼医学院的研究人员在国际期刊《科学》上发表了一篇题为CAR T cells produced in vivo to treat cardiac injury的研究论文。该研究表明,mRNA LNP注射可在体内直接制造CAR-T细胞,通过单次注射mRNA就可攻击特定目标,成功攻击了小鼠的心脏成纤维细胞,恢复心力衰竭小鼠的心脏功能。
嵌合抗原受体(CAR)T细胞技术是一种细胞免疫疗法,以患者自身的免疫细胞为靶点,直接用于对抗有害细胞。该技术需要采集患者的 T 细胞并在实验室中对其进行基因编辑,表达特定嵌合受体后再重新注入患者体内,从而实现靶向攻击特定细胞的目的。在这个过程中,患者就获得了针对特定抗原的免疫能力。
 (来源于参考材料[1])
(来源于参考材料[1])
CAR-T疗法目前主要的应用场景是治疗癌症,但应用于心衰或其他纤维化疾病时,由于通过重编程的CAR-T细胞可以在体内存活数个月甚至数年,在此期间它们会持续攻击成纤维细胞,导致伤口愈合能力被削弱。而研究团队将mRNA封装在气泡状的微型脂质纳米颗粒(LNPs)中,通过类似于mRNA疫苗的方式注射至小鼠体内后,被封装的mRNA分子被T细胞捕获,使得T细胞获得特异性靶向攻击心肌成纤维细胞的能力。由于mRNA并未整合到T细胞的DNA上,因此具有攻击性的T细胞只会存在几天。随后,T细胞恢复正常,不再保留对成纤维细胞的攻击性。
 (来源:Science)
(来源:Science)
随后几天,mRNA巨头之一Moderna和Carisma Therapeutics发布战略合作协议,以探索、开发和商业化用于癌症治疗的体内工程嵌合抗原受体单核细胞(CAR-M)疗法。关于上述合作,虽然尚未公开技术路线,但应与Science的报告的大体相同。研究设计靶向目标细胞的mRNA LNP,利用mRNA的基因编辑功能对目标细胞进行重编程,使其成为具备杀伤肿瘤细胞的特定靶向CAR-M细胞。
此项新研究拓展了mRNA平台的应用前景。利用mRNA LNP在体内对细胞进行改造和重编程,能够避免传统体外CAR细胞疗法的一系列复杂体外流程,大幅度降低制备难度和成本,意味着更廉价、更易获得的个性化治疗方案。另外,由于mRNA不会进入细胞核,不会对T细胞的DNA进行编辑,因此所改造的CAR细胞仅具有数天的攻击性,重具有潜在的可控安全性和耐受性。
同时,我们也应看到,作为一种全新的技术路线,该技术在实际应用于治疗中仍然存在大量可能的问题。如对于癌症患者来说,临床入组的癌症患者,大多在此前已经接受了多线治疗,体内免疫细胞的数量和质量已经很差,能否对于mRNA LNP产生响应,以产生足够的CAR免疫细胞进行肿瘤杀伤尚属未知。此外,靶向性问题、递送效率问题、毒性问题等都是该技术在实际投入应用之前必须解决的问题。
[1]JOEL G. RURIK et al. CAR T cells produced in vivo to treat cardiac injury. Science(2022).
[2]https://www.science.org/doi/10.1126/science.abm0594
关键词:
推荐新闻
必赢网址bwi437科技(688356.SH)祝您春节快乐!
2024-02-09
必赢网址bwi437科技(688356.SH) PEG衍生物的质量研究:案例大解析
2024-01-29
【强化质量 安全先行】必赢网址bwi437科技举办首届GMP&EHS知识普及与竞赛!
2023-11-09
【 邀请函 】必赢网址bwi437科技与您相约第七届circRNA研究与产业论坛
2023-11-09
分享到
bwin必赢唯一官方网站

微信公众号

微信公众号

